-
Critère d’évaluation principal
-
Critère d’évaluation secondaire
![Courbe de Kaplan-Meier de la survie sans progression (SSP) pour KYPROLIS + isatuximab + dexaméthasone/IsaKd (n=179) et KYPROLIS + dexaméthasone/Kd (n=123).
Proportion de patients survivant sans progression de 0 à 100 %. Mois depuis la répartition aléatoire de 0 à 24 mois.
Dans la population en intention de traiter, 103 événements (progression de la maladie ou décès), fondés sur les résultats évalués par le comité d’examen indépendant, se sont produits (48 événements dans le groupe IsaKd [26,8 %]; 55 événements dans le groupe Kd [44,7 %]).
L’étude a montré une amélioration significative de la SSP chez les patients du groupe IsaKd par rapport à ceux du groupe Kd (RR = 0,531, IC à 95 % : 0,318 à 0,889 [p = 0,0013]), 19,15 mois dans le groupe IsaKd par rapport à une médiane non atteinte dans le groupe Kd.
Patients à risque pour le schéma IsaKd : 179 au mois 0, 164 au mois 3, 151 au mois 6, 136 au mois 9, 124 au mois 12, 110 au mois 15, 100 au mois 18, 36 au mois 21 et 5 au mois 24.
Patients à risque pour le schéma Kd : 123 au mois 0, 108 au mois 3, 99 au mois 6, 85 au mois 9, 72 au mois 12, 61 au mois 15, 50 au mois 18, 19 au mois 21 et 6 au mois 24.
Les patients ont pris la IsaKd ou Kd jusqu’à la progression de la maladie ou l’apparition d’une toxicité inacceptable.](-/media/themes/amgen/amgencompass-ca/amgencompass-kyprolis/images/french/efficacy-data/ikema-study/ikema-study-1.png)
D’après la monographie du produit KYPROLIS1.
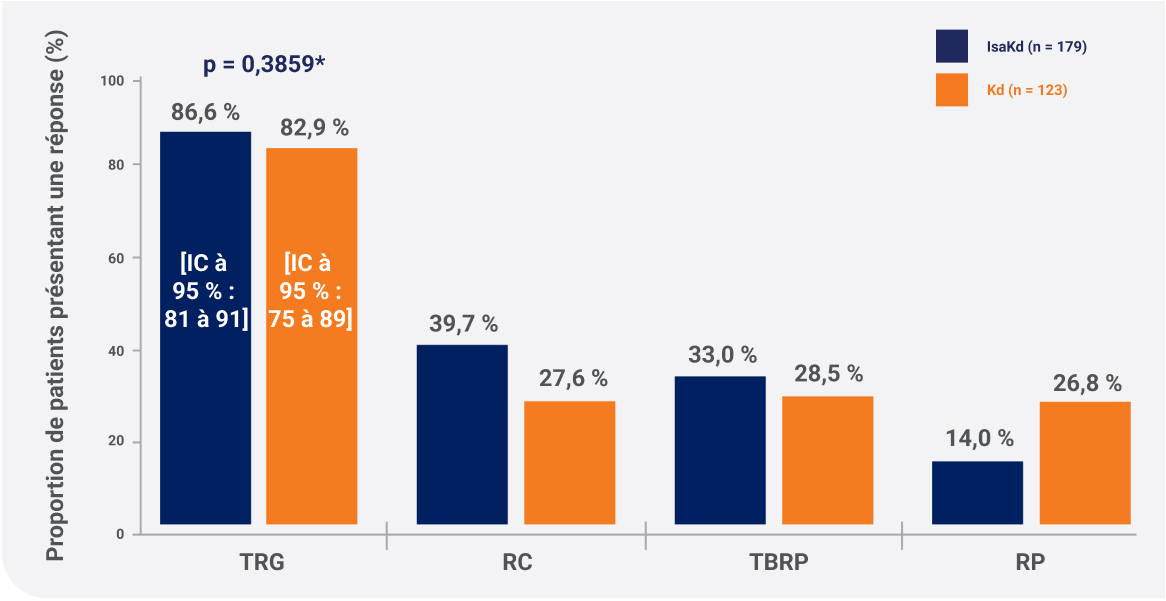
* Stratifiés selon le nombre de traitements antérieurs (1 et > 1) et R-ESI (I ou II vs III vs non classé) selon l’IRT.
IC, intervalle de confiance; RC, réponse complète; RR, rapport de risque; IsaKd, isatuximab + KYPROLIS + dexaméthasone; Kd, KYPROLIS + dexaméthasone; NP, non atteint; TRG, taux de réponse globale; SSP, survie sans progression; RP, réponse partielle; TBRP, très bonne réponse partielle.
| Caractéristiques | IsaKd (n = 179) | Kd (n = 123) |
|---|---|---|
| Âge | ||
| Médian (années) | 65 | 63 |
| Plage (années) | 55 à 70 | 57 à 70 |
| Distribution [nombre de patients (%)] | ||
| < 65 | 88 (49) | 66 (54) |
| 65 à 74 ans | 74 (41) | 47 (38) |
| ≥ 75 ans | 17 (9) | 10 (8) |
| Indice de performance ECOG [nombre de patients (%)] | ||
| 0 | 95 (53) | 73 (59) |
| 1 | 73 (40) | 45 (37) |
| 2 | 10 (6) | 5 (4) |
| Risque cytogène au début de l’étude [nombre de patients (%)] | ||
| Risque élevé* | 42 (23) | 31 (25) |
| Risque standard | 114 (64) | 78 (63) |
| Inconnu | 23 (13) | 14 (11) |
| Traitements antérieurs | IsaKd (n = 179) | Kd (n = 123) |
|---|---|---|
| 1 cycle de traitement antérieur | 79 (44) | 55 (45) |
| 2 cycles de traitement antérieur | 64 (36) | 36 (29) |
| 3 cycles de traitement antérieur | 33 (18) | 30 (24) |
| Greffe autologue | 116 (65) | 69 (56) |
| Traitement antérieur par un inhibiteur du protéasome | 166 (93) | 105 (85) |
| Traitement antérieur par un agent immunomodulateur | 136 (76) | 100 (81) |
| Traitement antérieur par lénalidomide | 72 (40) | 59 (48) |
| Traitement antérieur par daratumumab | 1 (1) | 0 (0) |
- Les patients atteints de myélome multiple récidivant ou réfractaire
- Les patients devaient avoir reçu de 1 à 3 cycles de traitements antérieurs
- Les patients étaient exclus s’ils présentaient une maladie réfractaire primaire ou s’ils étaient réfractaires à un traitement antérieur par anticorps monoclonaux anti-CD38
* Le statut cytogénétique à haut risque est défini comme la présence d’une del(17p) ou d’une translocation t(4;14) ou t(14;16).
ECOG, Eastern Cooperative Oncology Group; IT, intention de traiter; IsaKd, isatuximab + KYPROLIS + dexaméthasone; Kd, KYPROLIS + dexaméthasone.
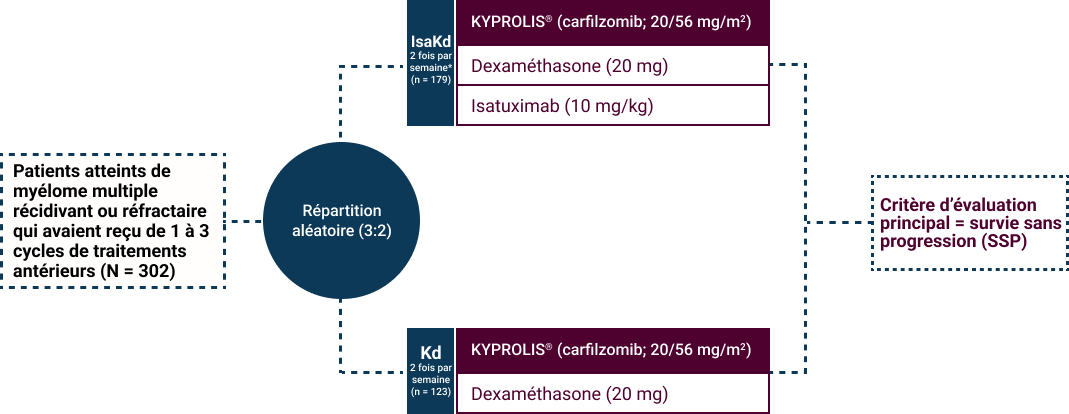
* Les cycles ont été répétés jusqu’à la progression de la maladie ou l’apparition d’une toxicité inacceptable. L’isatuximab a été administré chaque semaine au cours du premier cycle et toutes les deux semaines au cours des cycles suivants.
La SSP a été déterminée par un comité d’examen indépendant.1
IsaKd, isatuximab + KYPROLIS + dexaméthasone; Kd, KYPROLIS + dexaméthasone; SSP, survie sans progression.


