-
Critère d’évaluation principal
-
Critères d’évaluation secondaires
![Courbe de Kaplan-Meier de la survie sans progression (SSP) pour KYPROLIS + lénalidomide + dexaméthasone/KRd (n = 396) et lénalidomide + dexaméthasone/Rd (n = 396).
Proportion de patients survivant sans progression de 0 à 100 %. Mois depuis la répartition aléatoire de 0 à 48 mois.
Dans la population en intention de traiter, 431 événements (progression de la maladie ou décès), fondés sur les résultats évalués par le comité d’examen indépendant, se sont produits (207 événements dans le groupe KRd [52,3 %]; 224 événements dans le groupe Rd [56,6 %]).
Les patients du groupe KRd ont présenté une amélioration de la SSP comparativement à ceux du groupe Rd (RR = 0,69 [IC à 95 % : 0,57 à 0,83], p < 0,0001); 26,3 mois dans le groupe KRd par rapport à 17,6 mois dans le groupe Rd.
Patients à risque pour le schéma Rd : 396 au mois 0, 287 au mois 6, 206 au mois 12, 151 au mois 18, 117 au mois 24, 72 au mois 30, 18 au mois 36, 1 au mois 42 et 0 au mois 48.
Patients à risque pour le schéma KRd : 396 au mois 0, 332 au mois 6, 279 au mois 12, 222 au mois 18, 179 au mois 24, 112 au mois 30, 24 au mois 36, 1 au mois 42 et 0 au mois 48.
Les patients ont reçu KYPROLIS (carfilzomib) jusqu’au cycle 18.](-/media/themes/amgen/amgencompass-ca/amgencompass-kyprolis/images/french/efficacy-data/aspire-trial/proportion-de-patients-survivant-sans-progression.svg)
D’après la monographie de produit KYPROLIS1 et Stewart et coll.9
| Sous-groupe | KRd | Rd | |
|---|---|---|---|
| 1 cycle de traitement antérieur10 | SSP médiane (mois) | 29,6 | 17,6 |
| Événements de progression ou décès, n/N | 91/184 | 88/157 | |
| RR = 0,71 [IC à 95 % : 0,53 à 0,96] p = 0,0118; unilatéral | |||
| ≥ 2 cycles antérieurs de traitement10 | SSP médiane (mois) | 25,8 | 16,7 |
| Événements de progression ou décès, n/N | 116/212 | 136/239 | |
| RR = 0,72 [IC à 95 % : 0,56 à 0,92] p = 0,0046; unilatéral | |||
| Risque cytogénétique élevé11† | SSP médiane (mois) | 23,1 | 13,9 |
| Événements de progression ou décès, n/N | 31/48 | 32/52 | |
| RR = 0,70 [IC à 95 % : 0,43 à 1,16] p = 0,0829; unilatéral | |||
| Risque cytogénétique risque11† | SSP médiane (mois) | 29,6 | 19,5 |
| Événements de progression ou décès, n/N | 68/147 | 94/170 | |
| RR = 0,66 [IC à 95 % : 0,48 à 0,90] p = 0,0039; unilatéral | |||
Essai ouvert; analyse de sous-groupes prévue; les résultats n’ont pas été ajustés en fonction de la multiplicité et doivent être interprétés de manière descriptive10,11.
![Courbe de Kaplan-Meier de la survie globale (SG) pour KYPROLIS + lénalidomide + dexaméthasone/KRd (n = 396) et lénalidomide + dexaméthasone/Rd (n = 396).
Proportion de survie de 0 à 100 %. Mois depuis la répartition aléatoire de 0 à 78 mois.
L’analyse de la SG prévue a été effectuée après 246 décès dans le groupe KRd (62,1 %) et 267 décès dans le groupe Rd (67,4 %).
Un avantage statistiquement significatif sur le plan de la SG a été observé chez les patients du groupe KRd comparativement aux patients du groupe Rd (RR = 0,79 [IC à 95 % : 0,67 à 0,95; p = 0,0045]), avec 48,3 mois dans le groupe KRd par rapport à 40,4 mois dans le groupe Rd.
Patients à risque pour le schéma Rd : 396 au mois 0, 356 au mois 6, 313 au mois 12, 281 au mois 18, 243 au mois 24, 220 au mois 30, 199 au mois 36, 176 au mois 42, 149 au mois 48, 133 au mois 54, 113 au mois 60, 69 au mois 66, 20 au mois 72 et 3 au mois 78.
Patients à risque pour le schéma KRd : 396 au mois 0, 369 au mois 6, 343 au mois 12, 316 au mois 18, 282 au mois 24, 259 au mois 30, 232 au mois 36, 211 au mois 42, 190 au mois 48, 166 au mois 54, 149 au mois 60, 88 au mois 66, 22 au mois 72 et 0 au mois 78.
Les patients ont reçu KYPROLIS jusqu’au cycle 18.](-/media/themes/amgen/amgencompass-ca/amgencompass-kyprolis/images/french/efficacy-data/aspire-trial/aspire-study-graph-two-fr.jpg)
D’après Siegel et coll.12
- La SG médiane s’est améliorée de 7,9 mois chez les patients du groupe KRd comparativement à ceux du groupe Rd1
- L’analyse de la SG prévue a été effectuée après 246 décès dans le groupe KRd et 267 décès dans le groupe Rd1,12
- La durée médiane du suivi était d’environ 67,1 mois1,12
- 28,6 mois [IC à 95 % : 24,9 à 31,3] dans le groupe KRd par rapport à
- 21,2 mois [IC à 95 % : 16,7 à 25,8] dans le groupe Rd
* Le traitement par KYPROLIS a été administré pendant un maximum de 18 cycles, à moins qu’il n’ait été interrompu prématurément en raison d’une progression de la maladie ou l’apparition d’une toxicité inacceptable. L’administration de lénalidomide et de dexaméthasone pouvait se poursuivre jusqu’à la progression de la maladie ou l’apparition d’une toxicité inacceptable1.
† Pourcentages arrondis.
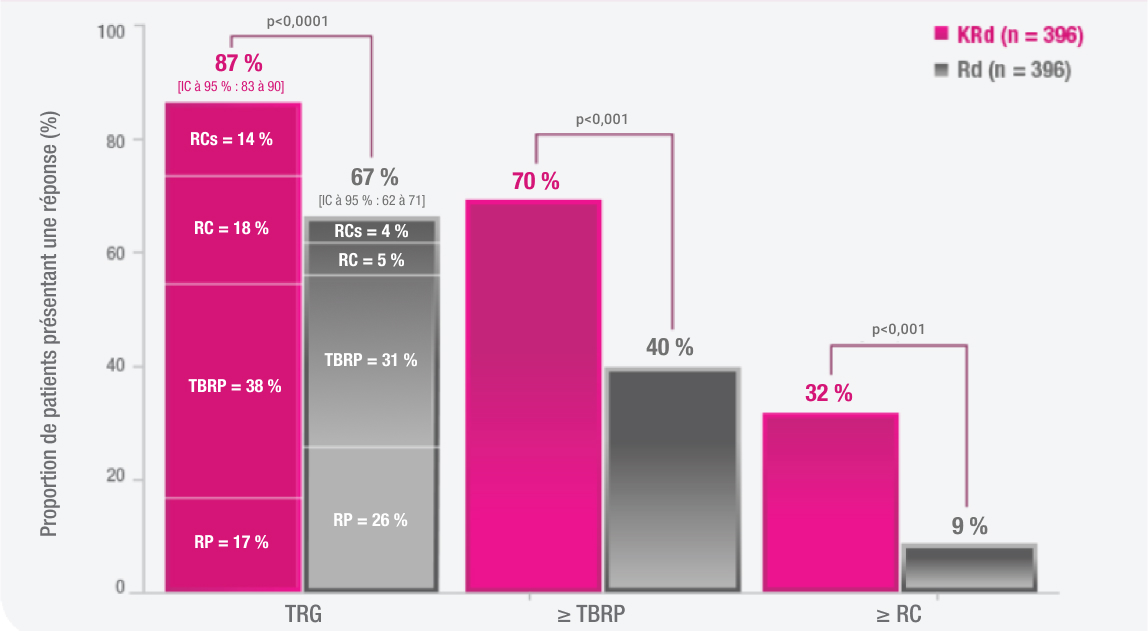
IC, intervalle de confiance; KRd, KYPROLIS + lénalidomide + dexaméthasone; RC, réponse complète; RCs, réponse complète stricte; RP, réponse partielle; RR, rapport de risque; SG, survie globale; SSP, survie sans progression; TBRP, très bonne réponse partielle; TRG, taux de réponse global; Rd, lénalidomide + dexaméthasone.
| Caractéristiques | KRd (n = 396) | Rd (n = 396) |
|---|---|---|
| Âge | ||
| Médian (années) | 64 | 65 |
| Plage (années) | 38 à 87 | 31 à 91 |
| Distribution [nombre de patients (%)] | ||
| 18 à 64 ans | 211 (53) | 188 (48) |
| ≥ 65 ans | 185 (47) | 208 (53) |
| Indice de performance ECOG [nombre de patients (%)] | ||
| 0 ou 1 | 356 (90) | 361 (91) |
| 2 | 40 (10) | 35 (9) |
| Risque cytogène au début de l’étude [nombre de patients (%)] | ||
| Risque élevé | 48 (12) | 52 (13) |
| Risque standard | 147 (37) | 170 (43) |
| Inconnu | 201 (51) | 174 (44) |
| Clairance de la créatinine* | ||
| Médiane (mL/min) | 79 (39 à 212) | 79 (30 à 208) |
| Distribution [nombre de patients (%)] | ||
| 30 à < 50 mL/min | 19 (5) | 32 (8) |
| 50 à < 80 mL/min | 185 (47) | 170 (43) |
| ≥ 80 mL/min | 192 (49) | 194 (49) |
| Schémas antérieurs† | KRd (n = 396) | Rd (n = 396) |
|---|---|---|
| 1 schéma | 184 (47) | 157 (40) |
| 2 ou 3 schémas | 211 (53) | 238 (60) |
| Greffe | 217 (55) | 229 (58) |
| Bortézomib | 261 (66) | 260 (66) |
| Lénalidomide | 79 (20) | 78 (20) |
- Le bortézomib antérieur était autorisé à condition que les patients n’aient pas présenté de progression de la maladie pendant le traitement
- La lénalidomide et la dexaméthasone (Rd) antérieures étaient autorisées à condition que les patients n’aient pas interrompu le traitement en raison d’effets indésirables, qu’ils aient présenté une progression de la maladie au cours des 3 premiers mois de traitement ou qu’ils présentent une progression à tout moment pendant le traitement si Rd était leur traitement le plus récent
* Les patients devaient avoir une clairance de la créatinine de ≥ 50 mL/min à la sélection; un patient du groupe Rd avait une clairance de la créatinine initiale de < 30 mL/min9.
† Un patient (0,3 %) dans chaque groupe a reçu 4 schémas thérapeutiques antérieurs9.
IT, intention de traiter; KRd, KYPROLISMD + lénalidomide + dexaméthasone; Rd, lénalidomide + dexaméthasone.

* Le traitement par KYPROLIS (carfilzomib) a été administré pendant un maximum de 18 cycles, à moins qu’il n’ait été interrompu prématurément en raison d’une progression de la maladie ou l’apparition d’une toxicité inacceptable. L’administration de lénalidomide et de dexaméthasone pouvait se poursuivre jusqu’à la progression de la maladie ou l’apparition d’une toxicité inacceptable1.
† Les cycles ont été répétés jusqu’à la progression de la maladie ou l’apparition d’une toxicité inacceptable1.
La SSP a été déterminée par un comité d’examen indépendant1.
KRd, KYPROLIS + lénalidomide + dexaméthasone; Rd, lénalidomide + dexaméthasone; SSP, survie sans progression.


